- 依循標準
ISO 10993-6
- 試驗體系
大鼠、大白兔
- 試驗目的與方法
評估醫療器材引發局部反應(local effects)之潛在可能性。
依據測試物之臨床適應症選擇植入部位(肌肉、骨頭、皮下、腦或其他部位),觀察其臨床症狀與分析植入物周邊組織病理反應。
生物相容性ISO 10993
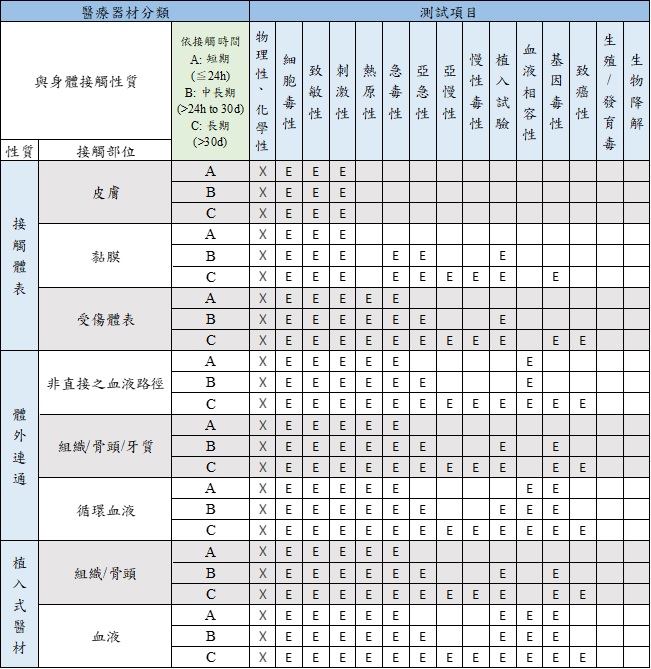
修改自ISO 10993-1:2018版Table A.1-Endpoints to be addressed in a biological risk assessment
註:
1) 首要蒐集產品材料的物理性及化學性資料並進行生物相容性風險評估。
2) 新版標準測試項目增加了熱原性(Material mediated Pyrogenicity)、慢毒性(Chronic toxicity)、致癌性(Carcinogenicity) 、生殖毒性及生物降解性。
3) X表示生物相容性風險評估前置作業,E表示要在風險評估中評估的試驗指標,可藉由進行試驗或是風險評估報告完成該試驗指標的評估。
植入試驗 Implantation test 

