Uncategorised 文章數: 1
首頁 文章數: 0
首頁slider 文章數: 2
首頁slider-m 文章數: 1
臨床前試驗委託 文章數: 8
測試與服務 文章數: 0
新藥研發試驗 文章數: 0
麥德凱生科於2019年10月,取得SNBL的臺灣正式代理權,將助力臺灣新藥於研發階段取得中、大型動物及靈長類非臨床試驗,並為打入日本市場提供利基,促進臺灣生技新藥臨床前開發。
臨床前試驗 文章數: 17
SNBL is the first CRO in Japan and have since steadily expanded and innovated to become the world's largest non-human primate drug safety research facility. They strive to be the leader in animal welfare in Asia, providing quality scientific data while continuously focusing on the 3Rs.
SNBL是日本第一家CRO,從創立以來穩步擴展及不斷創新,成為全球最大的非人類靈長類藥物安全性研究機構,致力於成為亞洲動物福利領域的領導者,落實取代、減量、精緻化之動物科學應用3R 原則並提供高品質的科學數據。
研究開發支援 文章數: 4
Strong Support Systems and Qualifications
Being Japan's largest preclinical facility allows us the flexibility to accommodate a wide variety of products and study types.
- Approved for GLP and GCP
- Management of biosafrty for pathogens and living modified organisms(LMOs)
- Consultation for studies and refulations
- Electronic submission to FDA for INDs and NDAs available (CDISC SEND)
作為日本最大的臨床前試驗機構,可針對各項產品及研究類型提供服務。
- 可提供各種GLP服務
- 可提供生物安全及基因改造試驗服務
- 學術支援(諮詢、製作CTD等)
- 可提供FDA IND/NDA電子化申請服務(CDISC SEND)
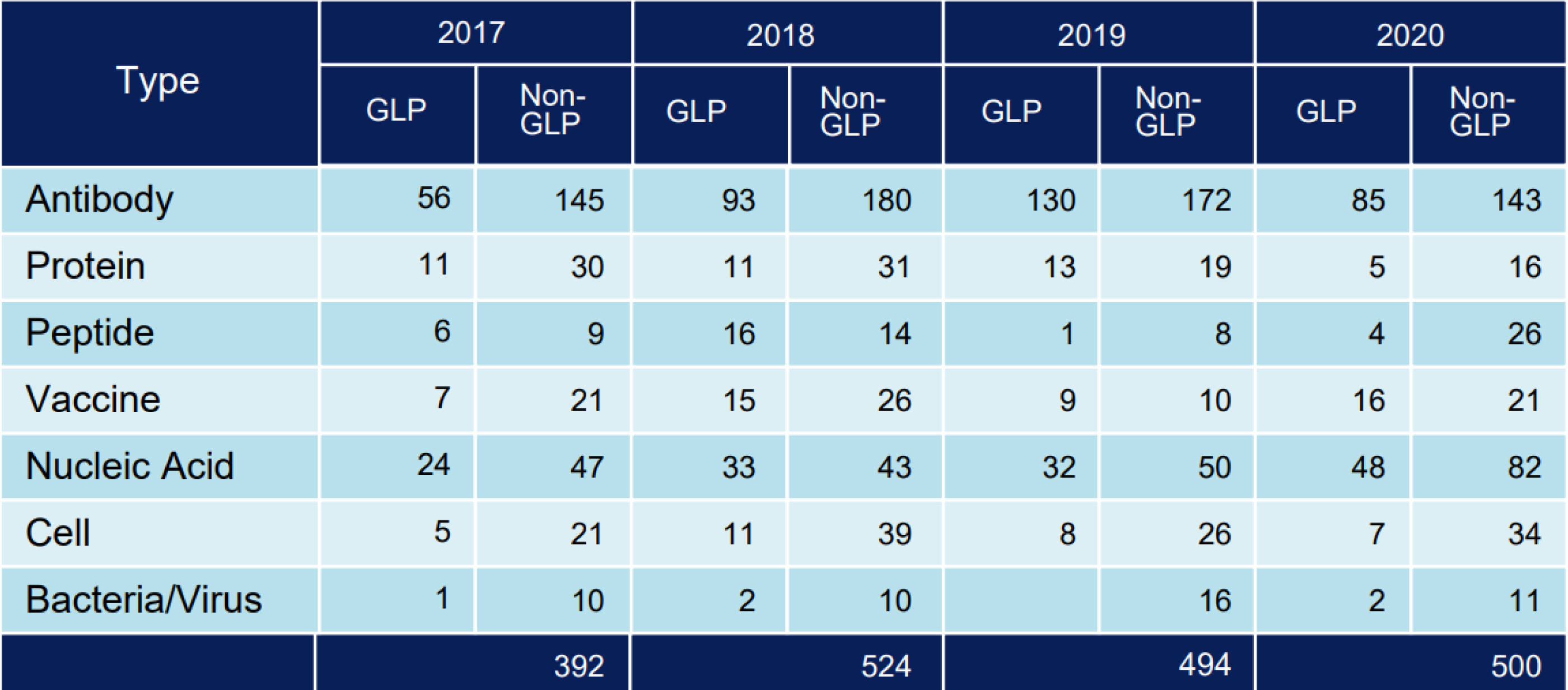
生物醫藥品及再生醫療 文章數: 5
Experience in Evaluation of Biopharmaceuticals and Cell and Gene Therapy Products
- Over 2000 studies on biopharmaceuticals in the past 5 years
- Over 120 studies on cell and gene thaerapy products
在生物醫藥品以及再生醫療製品已有多項經驗
- 評估實績在生物醫藥品上已超過2000個試驗
- 再生醫療等製品已超過120個試驗。
新藥開發及申請 文章數: 4
One-Stop Service, Medical Writing, and Consulting for Drug Development
Nonclinical pharmaceutical affairs experts, study directors, and project managers who are experienced Japan and overseas countries offer a one-stop service as scientific monitors.
Staff experienced with the preparation of investigator's brochures(IB) and CTD or experienced study direcrors offer medical writing as scientific writers.
Sciencetific monitor or writers are able to consult on various matters according to your needs.
由經驗豐富的日本及各國非臨床藥物專家、試驗主持人以及專案管理員,進行監督並提供完整的one-stop 服務。
並由具有撰寫 investigator's brochures(IB)、CTD經驗的人員或經驗豐富的研究人員協助準備需求文件。
這些專業人士可以協助您所想諮詢的各種事項。
細胞治療、藥品 文章數: 0
麥德凱生科可執行藥品、細胞治療產品研發時的協助試驗,幫助廠商在初期時了解物質之安全性、功效性;並且藥物申請時,所有的毒理試驗都應遵循優良實驗操作規範。亦提供藥品批次檢驗放行之服務,使得藥物能夠順利生產、出貨,同時為藥廠以及消費者提供安全把關。
對於藥品的安全性規範,目前麥德凱生科可提供OECD法規、日本藥典、美國藥典、藥品非臨床試驗安全性規範、中華藥典之安全性試驗服務,由於藥品試驗多數以個案討論毒理試驗的執行,因此不及備載,歡迎與我們聯繫討論。
化學品 文章數: 0
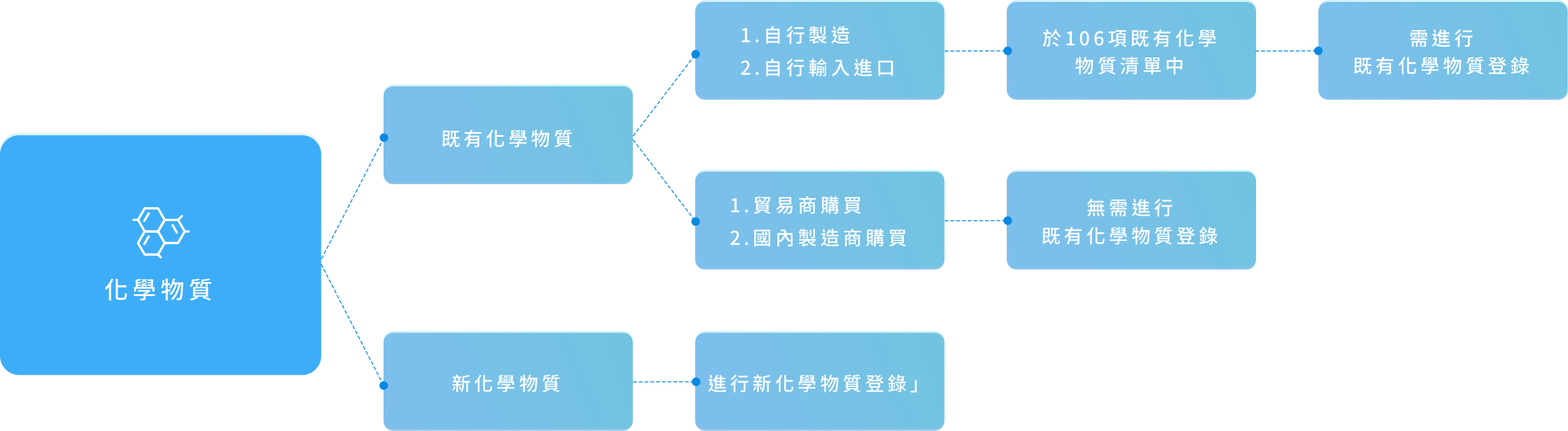
既有化學品 文章數: 10
新化學品 文章數: 10
化學物質以年總量噸數級距作為基準。
化學物質噸數計算為輸入或製造一個年度的估算,並依每年製造或輸入量及物質種類分為標準登錄、簡易登錄及少量登錄。
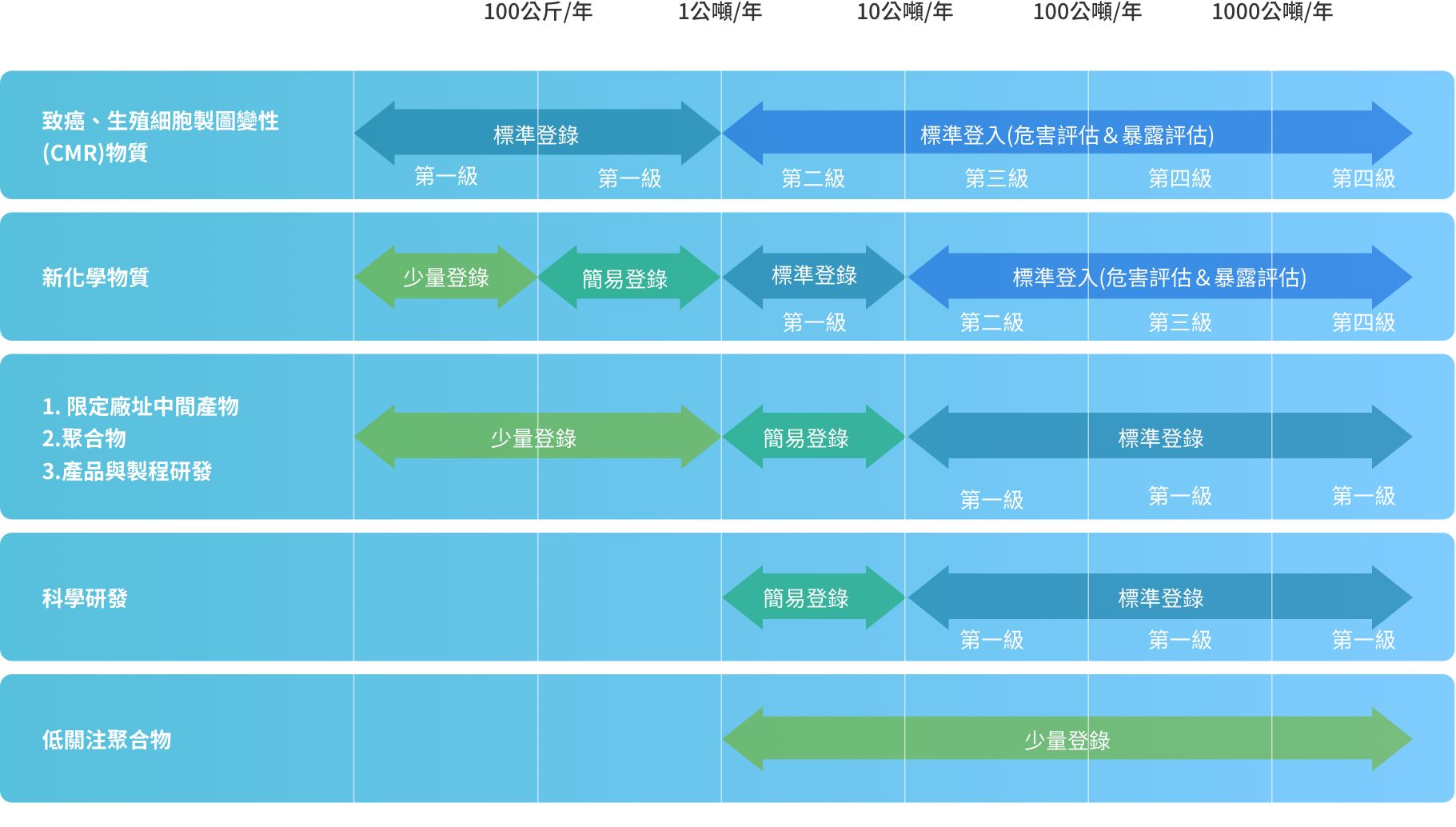
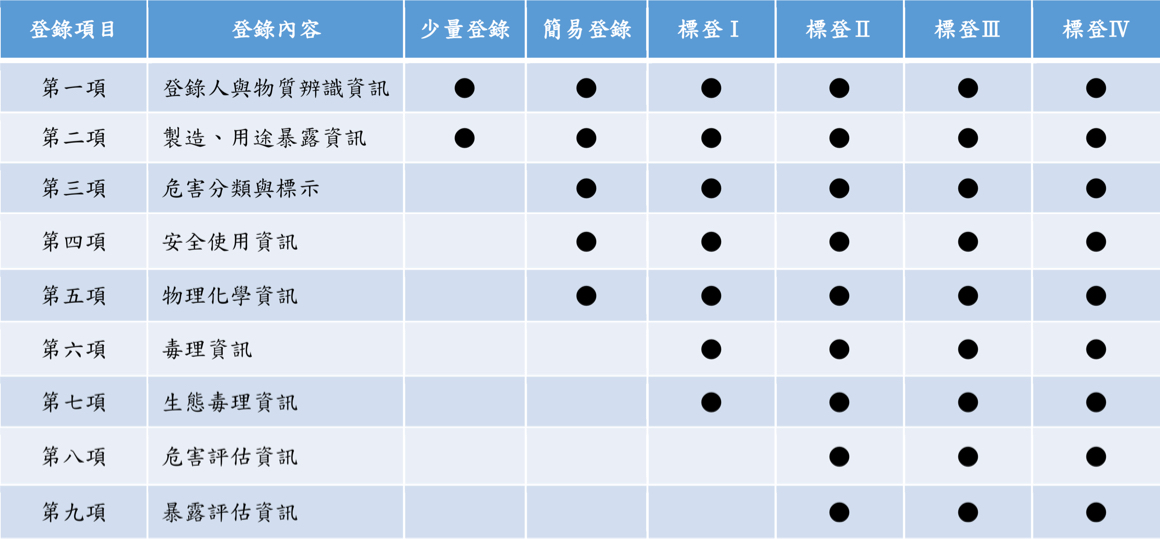
依照製造或輸入量及物質種類分為少量登錄、簡易登錄及標準登錄,所需提交資料有所不同。
| 登錄項目 | 登錄內容 | 少量登錄 | 簡易登錄 | 標登Ⅰ | 標登Ⅱ | 標登Ⅲ | 標登Ⅳ |
|---|---|---|---|---|---|---|---|
| 第一項 | 登錄人與物質辨識資訊 | ● | ● | ● | ● | ● | ● |
| 第二項 | 製造、用途暴露資訊 | ● | ● | ● | ● | ● | ● |
| 第三項 | 危害分類與標示 | ● | ● | ● | ● | ● | |
| 第四項 | 安全使用資訊 | ● | ● | ● | ● | ● | |
| 第五項 | 物理化學資訊 | ● | ● | ● | ● | ● | |
| 第六項 | 毒理資訊 | ● | ● | ● | ● | ||
| 第七項 | 生態毒理資訊 | ● | ● | ● | ● | ||
| 第八項 | 危害評估資訊 | ● | ● | ● | |||
| 第九項 | 暴露評估資訊 | ● | ● | ● |
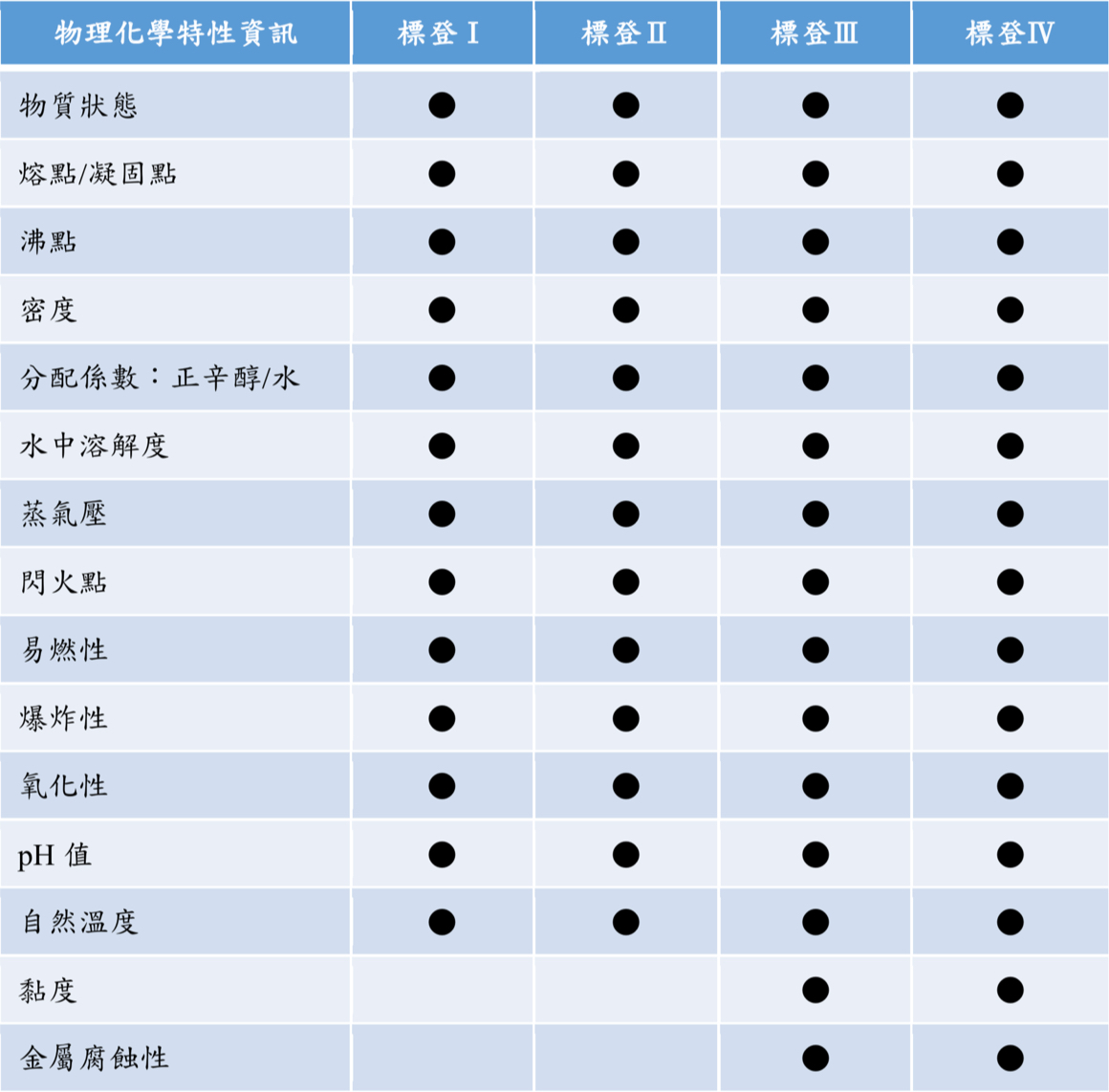
| 物理化學特性資訊 | 標登Ⅰ | 標登Ⅱ | 標登Ⅲ | 標登Ⅳ |
|---|---|---|---|---|
| 物質狀態 | ● | ● | ● | ● |
| 熔點/凝固點 | ● | ● | ● | ● |
| 沸點 | ● | ● | ● | ● |
| 密度 | ● | ● | ● | ● |
| 分配係數:正辛醇/水 | ● | ● | ● | ● |
| 水中溶解度 | ● | ● | ● | ● |
| 蒸氣壓 | ● | ● | ● | ● |
| 閃火點 | ● | ● | ● | ● |
| 易燃性 | ● | ● | ● | ● |
| 爆炸性 | ● | ● | ● | ● |
| 氧化性 | ● | ● | ● | ● |
| pH值 | ● | ● | ● | ● |
| 自然溫度 | ● | ● | ● | ● |
| 黏度 | ● | ● | ||
| 金屬腐蝕性 | ● | ● |
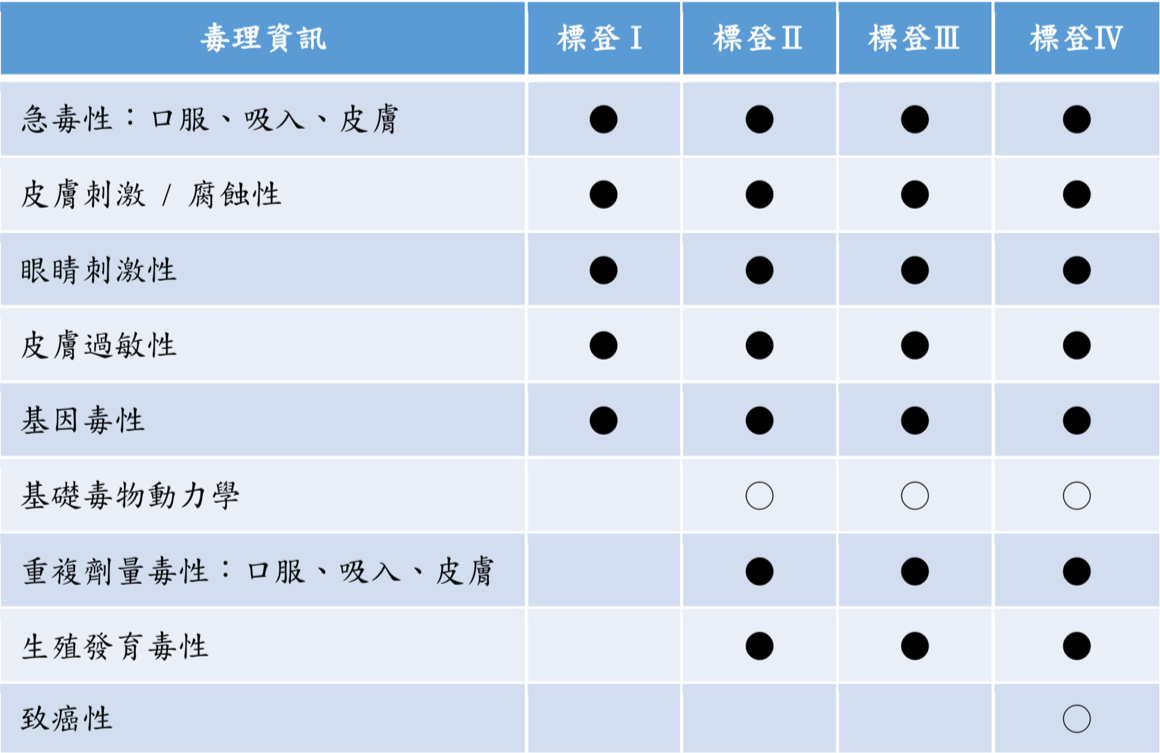
| 毒理資訊 | 標登Ⅰ | 標登Ⅱ | 標登Ⅲ | 標登Ⅳ |
|---|---|---|---|---|
| 急毒性:口服、吸入、皮膚 | ● | ● | ● | ● |
| 皮膚刺激 / 腐蝕性 | ● | ● | ● | ● |
| 眼睛刺激性 | ● | ● | ● | ● |
| 皮膚過敏性 | ● | ● | ● | ● |
| 基因毒性 | ● | ● | ● | ● |
| 基礎毒物動力學 | ○ | ○ | ○ | |
| 重複劑量毒性:口服、吸入、皮膚 | ● | ● | ● | |
| 生殖發育毒性 | ● | ● | ● | |
| 致癌性 | ○ |
○:可繳交測試計畫書代替測試報告。
●:需繳交測試報告。
更多登錄工具說明,請見點擊下載新化學物質及既有化學物質資料登錄工具說明第一版
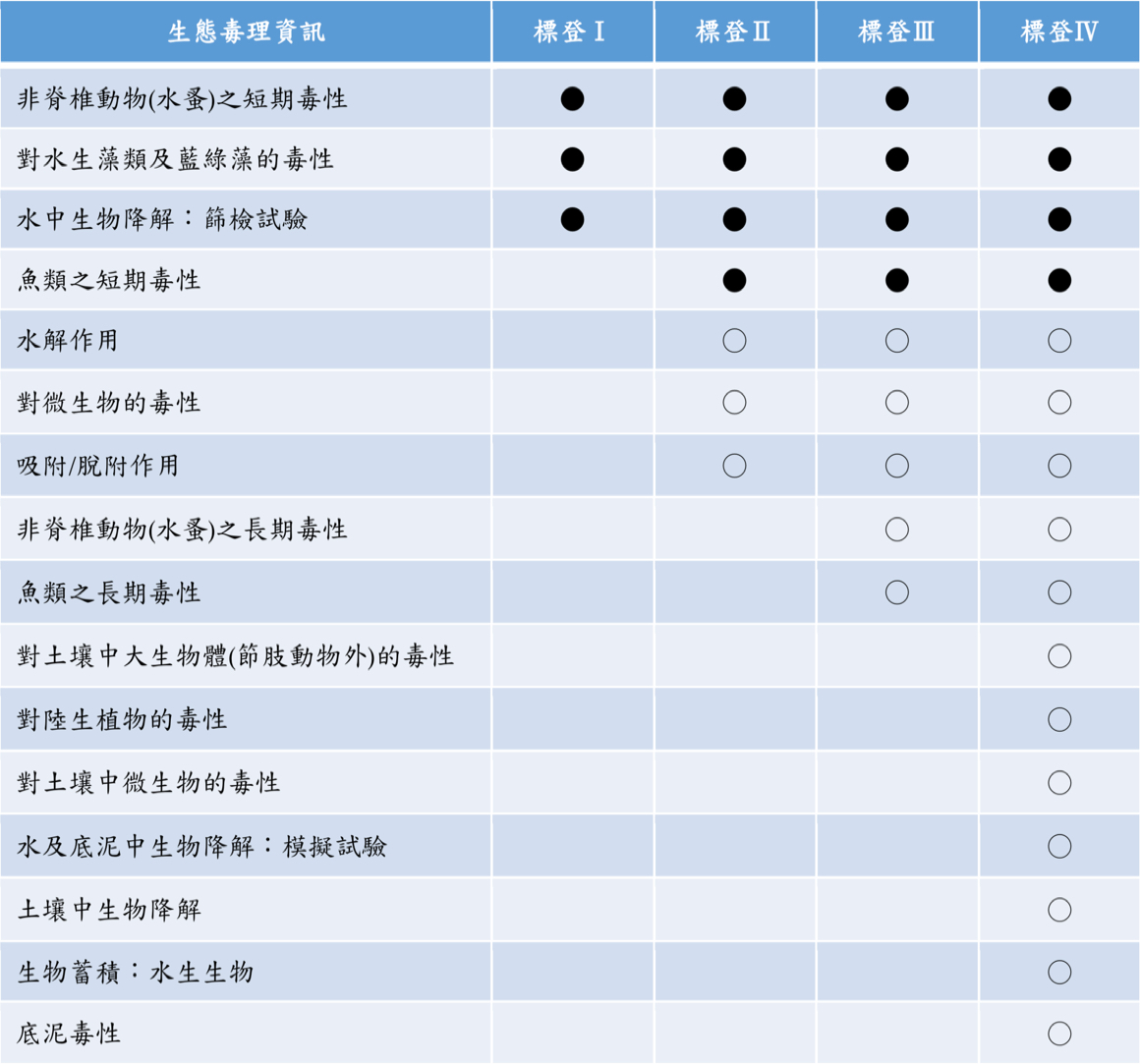
| 生態毒理資訊 | 標登Ⅰ | 標登Ⅱ | 標登Ⅲ | 標登Ⅳ |
|---|---|---|---|---|
| 非脊椎動物(水蚤)之短期毒性 | ● | ● | ● | ● |
| 對水生藻類及藍綠藻的毒性 | ● | ● | ● | ● |
| 水中生物降解:篩檢試驗 | ● | ● | ● | ● |
| 魚類之短期毒性 | ● | ● | ● | |
| 水解作用性 | ● | ● | ● | |
| 對微生物的毒性 | ○ | ○ | ○ | |
| 吸附/脫附作用 | ○ | ○ | ○ | |
| 非脊椎動物(水蚤)之長期毒性 | ○ | ○ | ||
| 魚類之長期毒性 | ○ | ○ | ||
| 對土壤中大生物體(節肢動物外)的毒性 | ○ | |||
| 對陸生植物的毒性 | ○ | |||
| 對土壤中微生物的毒性 | ○ | |||
| 水及底泥中生物降解:模擬試驗 | ○ | |||
| 土壤中生物降解 | ○ | |||
| 生物蓄積:水生生物 | ○ | |||
| 底泥毒性 | ○ |
○:可繳交測試計畫書代替測試報告。
●:需繳交測試報告。
登錄服務 文章數: 3
依照製造或輸入量及物質種類分為少量登錄、簡易登錄及標準登錄,所需提交資料有所不同。
○:可繳交測試計畫書代替測試報告。
●:需繳交測試報告。
○:可繳交測試計畫書代替測試報告。
●:需繳交測試報告。
農業、環境用藥 文章數: 0
農藥及環境用藥毒理試驗細節介紹:遵循OECD系列法規
為提供更好生活環境品質,國內業者致力發展環境用藥(如防蚊液)與農藥(植物保護劑),朝向低毒性、高效化、低量化、環境中易降解及相容性高等特性。行政院農業委員會為確保農藥及環境用藥對消費者、農民及環境之安全性,依據《農藥理化性及毒理試驗準則》,產品需事先審核其毒理學資料,並且相關毒理評估試驗需要在符合GLP認證之實驗室執行。
麥德凱生科為GLP認證合格實驗室,集結超過15年臨床前試驗經驗的博士級試驗主持人及獸醫師,秉持專業的態度與實驗技術,協助農藥及環境用藥業者在更短的期程內完成毒理學評估報告,為產品縮短上市期程,並且提供完整可信之科學佐證。
檔案下載
食品 文章數: 0
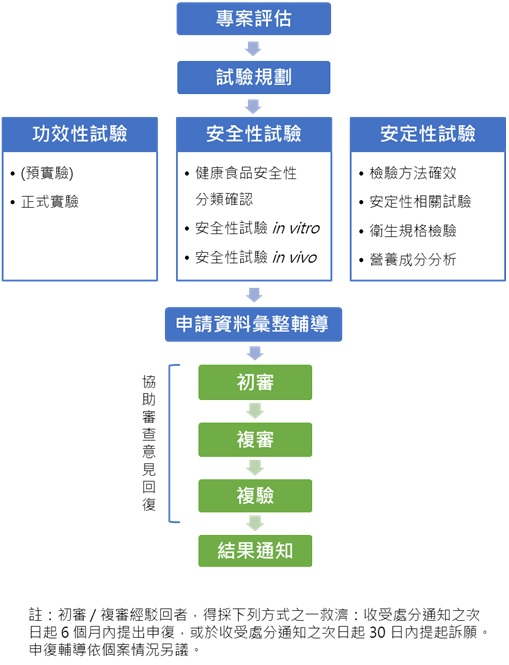
從農畜水產作物到機能性原料、再到成為保健食品與健康食品,麥德凱生科陪伴無數企業完成產品加值化研發歷程,透過科學化試驗數據,支持您的產品每一步的安全性、安定性與功效性驗證,協助食品業者強化對產品品質的管控,並透過日本麥德凱株式會社,與您攜手將台灣優質產品邁向國際市場。
功效性試驗 文章數: 11
麥德凱生科秉持專業態度與實驗技術,提供健康食品保健功效評估試驗及其客製化試驗設計,可協助依您的產品功能與研發需求,進行較小規模之階段性實驗,幫助篩選、測試產品的功效性與劑量,降低新品開發之成本與風險,並作為後續應用發展的基礎。

安全性試驗 文章數: 0
食品首重安全,安全性試驗首重優良實驗室操作 (Good Laboratory Practice, GLP)。麥德凱生科之毒理試驗具備財團法人全國認證基金會TAF OECD GLP及衛生福利部食品藥物管理署TFDA GLP雙重認證,可提供依據台灣衛生福利部公告之健康食品安全評估方法或國際經濟合作暨發展組織(Organization of Economic Cooperation and Development, OECD) 化學品測試指引之方法 (Guidelines for the Testing of Chemicals) 執行的安全性評估試驗,為您的產品提供完整的毒理試驗規劃與服務。
健康食品 文章數: 7
根據健康食品管理法,為確保健康食品之人體食用安全性,健康食品需以科學化方式證明其無害人體健康,且成分具有明確保健功效。依據健康食品安全評估方法規範,產品所使用的原料不同,需進行不同類別的安全性評估試驗,主要可分為四類如下:
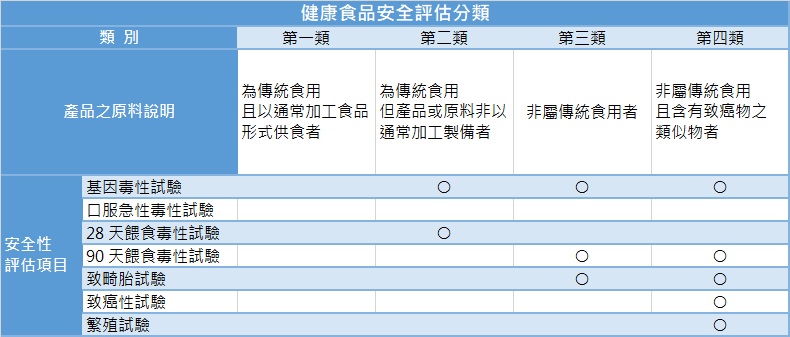
○:需進行試驗
麥德凱生科之毒理試驗具有TAF OECD GLP及TFDA GLP雙重認證,能協助依據您產品所使用的原料特性,提供完整的毒理試驗建議與服務,並可協助業者檢附相關資料,向主管機關函詢確認產品之安全性分類。如果您有需要健康食品安全性評估試驗方面的協助,歡迎聯絡我們。
非傳統性食品原料 文章數: 7
隨著科技進步及國際貿易交流頻繁,新興食品原料愈來愈多,此外也有許多傳統性食品原料經非傳統性培育、繁殖,或利用新穎加工技術改變原有組成或成分含量,而使其物理化學特性改變,這些都是屬於「非傳統性食品原料」之範疇,需經安全性評估以確定其食用安全性。
依據衛生福利部於2018年5月10日發布之非傳統性食品原料申請作業指引,「非傳統性食品原料」的定義有二種,若經判定須辦理非傳統性食品原料申請,則應分別檢附下列安全性評估資料:

符合指引「定義一」之非傳統性食品原料,且如北美、歐洲、紐澳及東北亞四個地區中,未達兩個 (含) 以上的國家准許申請原料之食用時,則申請案應檢附至少一種試驗動物 (至少是大鼠) 之 90 天餵食毒性試驗資料,且前述資料須為具優良實驗室操作規範 (GLP) 認證之動物實驗室執行相關動物試驗並提出試驗結果報告。
麥德凱生科為具有TAF OECD GLP及TFDA GLP雙重認證之動物實驗室的專業委託研究機構,能協助依您的非傳統性食品原料特性,提供不同的毒理試驗建議與服務,歡迎聯絡我們
牛樟芝 文章數: 1
牛樟芝為台灣特有之原生真菌,又稱為樟菇、牛樟菰、紅樟芝等,於可供食品使用原料一覽表中,公告的牛樟芝學名有Antrodia camphorate, Antrodia cinnamomea, Taiwanofungus camphoratus,其可食用部位分為子實體及菌絲體,一般常見的栽培方式包含段木栽培、固態培養、液態發酵等。
牛樟芝長久以來廣泛被應用於養生保健,市面上亦將其製成多種產品類型販售,惟國內曾有研究指出牛樟芝於高劑量使用下,恐有毒性及導致細胞病變的安全疑慮。因此為有效及合理管理牛樟芝食品,確保消費者食的安全與選購產品之權益,衛福部於2015年7月10日公告訂定「牛樟芝食品管理及標示相關規定」,內容如下:
- 自2016年7月11日起,食品使用牛樟芝為原料時,食品業者應具備該原料之詳細加工或製造過程、規格及90天餵食毒性試驗報告等相關證明文件,上市前送衛生福利部備查。
- 自2017年1月11日起,牛樟芝食品應依下列規定標示:
(一) 於產品外包裝以中文加註「嬰幼兒、孕婦、哺餵母乳者,如欲食用本產品,請洽詢醫師或醫療專業人員」之警語字樣。
(二) 於產品外包裝明確標示原料使用部位為子實體或菌絲體及其培養方式。
假如未依前述規範進行,相關罰則包含:
|
未依「牛樟芝食品管理及標示相關規定」,於產品上市前完成備查 |
依食安法第47條規定得處新臺幣3萬元以上300萬元以下罰鍰 |
|
以未經備查之牛樟芝原料製造食品,如未經證明為無害人體健康 |
依食安法第15條處辦,依同法第44條處新臺幣6萬元以上2億元以下罰鍰 |
|
未依上開規定標示警語、原料使用部位及其培養方式 |
依食安法第22條處辦,依同法第47條處新臺幣3萬元以上300萬元以下罰鍰 |
麥德凱生科執行之90天餵食毒性試驗已成功協助許多廠商順利取得牛樟芝原料備查核准,且試驗遵循優良實驗室操作 (GLP) 規範,確保各項試驗數據之品質,及試驗之完整性與可信度,是能幫助您的牛樟芝原料順利上市販售的優質首選夥伴,歡迎聯絡我們。
常見問題:
牛樟芝原料備查資料有哪些?
牛樟芝食品管理及標示相關規定問答集
查驗登記 文章數: 0
麥德凱生科參照台灣衛生福利部食品藥物管理署公佈的查驗登記相關作業辦法,提供食品類之查驗登記代辦及專業諮詢服務,並可執行相關試驗或檢測。成立至今已協助多家業者成功取得各類查驗登記許可,累積豐富經驗。如果您需要辦理查驗登記的協助,歡迎聯絡我們
健康食品查驗登記 文章數: 1
健康食品概說
「健康食品」與一般所稱的「保健食品」並不相同,自從1999年8月3日「健康食品管理法」施行後,「健康食品」已成為法律名詞,係指具有保健功效,並標示或廣告其具該功效,且須具有實質科學證據,並經衛生福利部審查通過後的食品。
一般「保健食品」雖然具有保健功效成分,但並未取得衛生福利部審查核准,因此無法宣稱保健功效。若一般「保健食品」未取得健康食品許可證而宣稱為「健康食品」、或具有健康食品之保健功效 (目前共13項),則可依違反健康食品管理法,移送法辦。
核准通過的「健康食品」須於產品包裝標示健康食品、核准之證號、標章及保健功效等相關規定項目,但仍須留意不得涉及醫療效能、虛偽不實、誇張或超出許可範圍的保健功效宣稱。
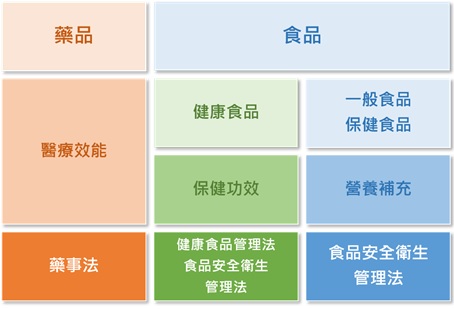
健康食品查驗登記採雙軌制

健康食品查驗登記申請流程
由「財團法人醫藥品查驗中心(CDE)」受託辦理健康食品查驗登記之新案、許可文件換發、補發、展延、轉移、註銷及登記事項變更等業務,其新案申請流程如下:
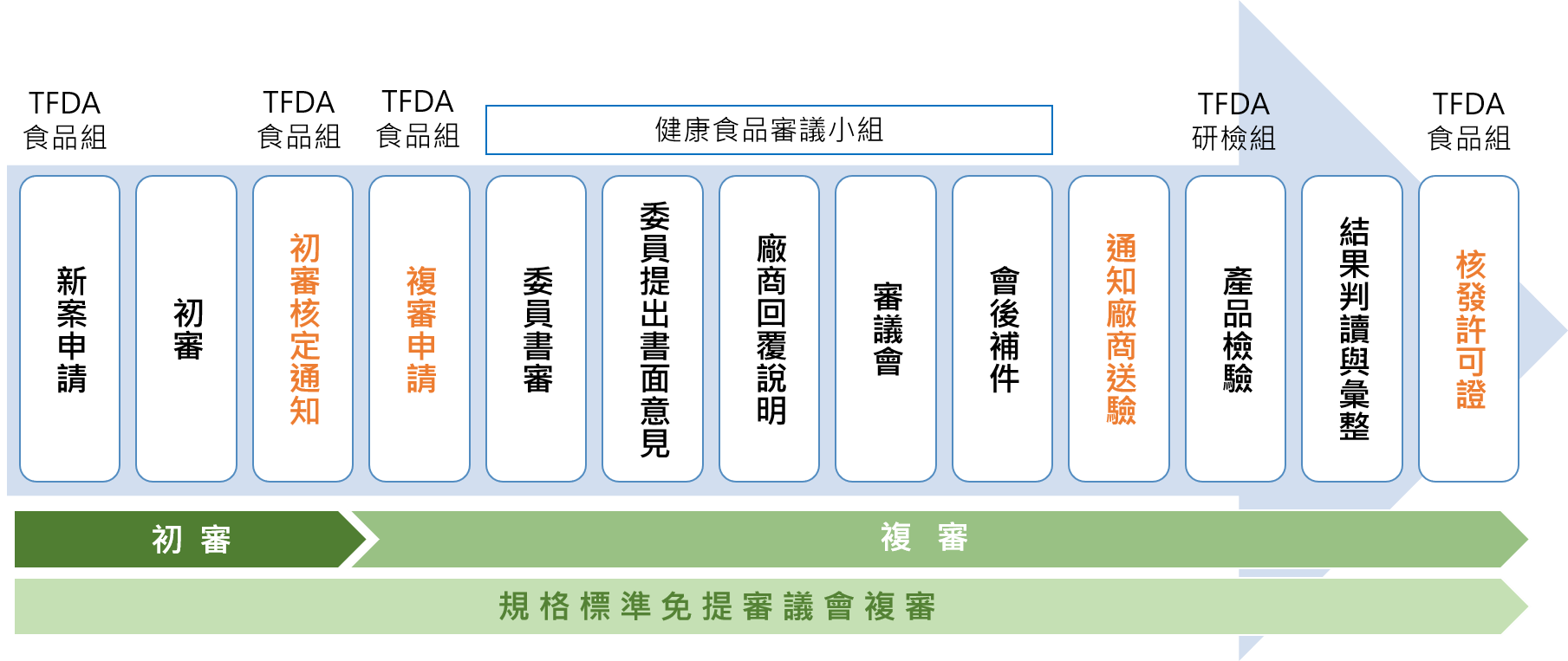
健康食品查驗登記所需文件
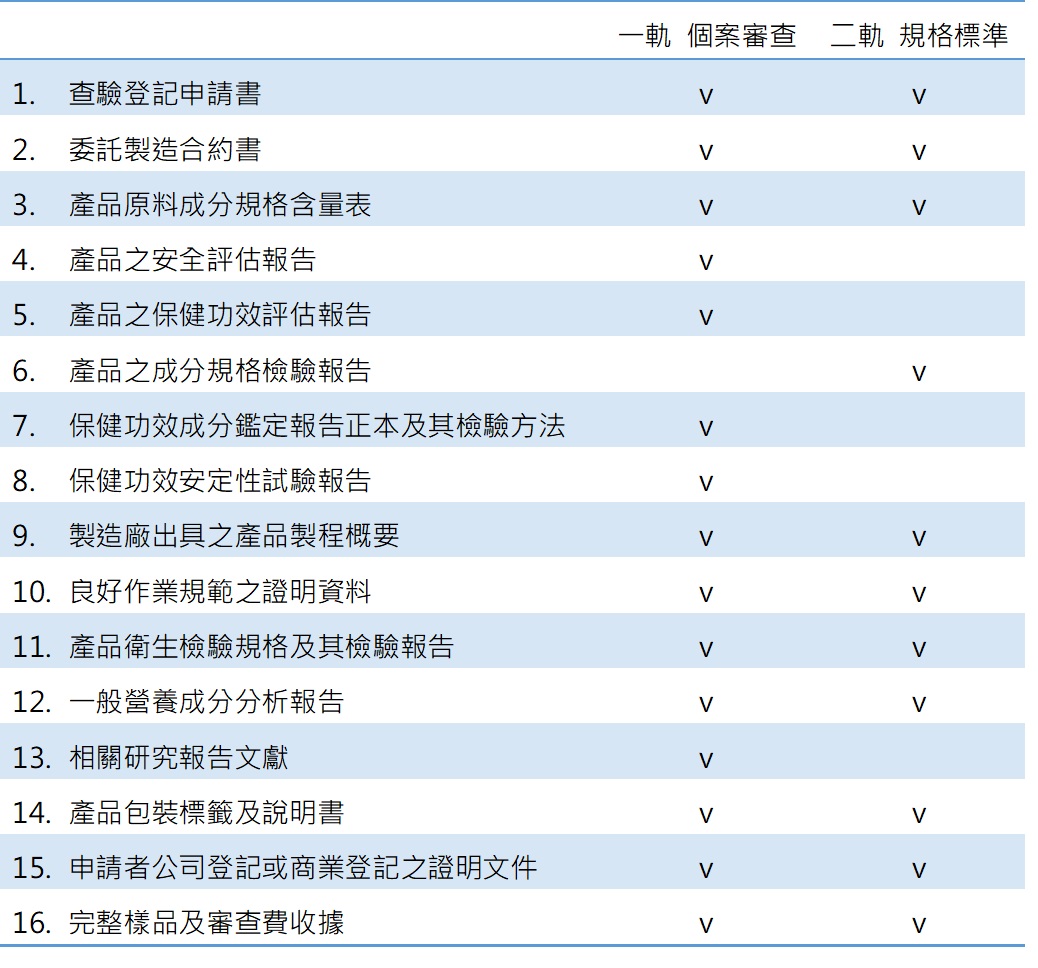
健康食品整合服務流程
許可文件展延、變更、移轉、遺失補發
麥德凱生科亦提供辦理健康食品許可證之展延、變更、轉移等服務,如果您需要查驗登記申請或許可文件展延變更等協助,歡迎聯絡我們。
衍伸閱讀:健康食品安全性試驗、健康食品功效性試驗、健康食品安定性試驗常見問題 > 食品
輸入膠囊狀錠狀食品查驗登記 文章數: 1
輸入錠狀膠囊狀食品查驗登記
依據衛生福利部於2014年1月8日部授食字第1021351782號規定,輸入錠狀、膠囊狀食品應向中央主管機關辦理查驗登記。
輸入錠狀膠囊狀食品查驗登記申請流程
由「財團法人台灣優良農產品發展協會(CAS)」受託辦理輸入錠狀膠囊狀食品查驗登記之新案、許可文件換發、補發、展延、轉移、註銷及登記事項變更等業務,其新案申請流程如下:
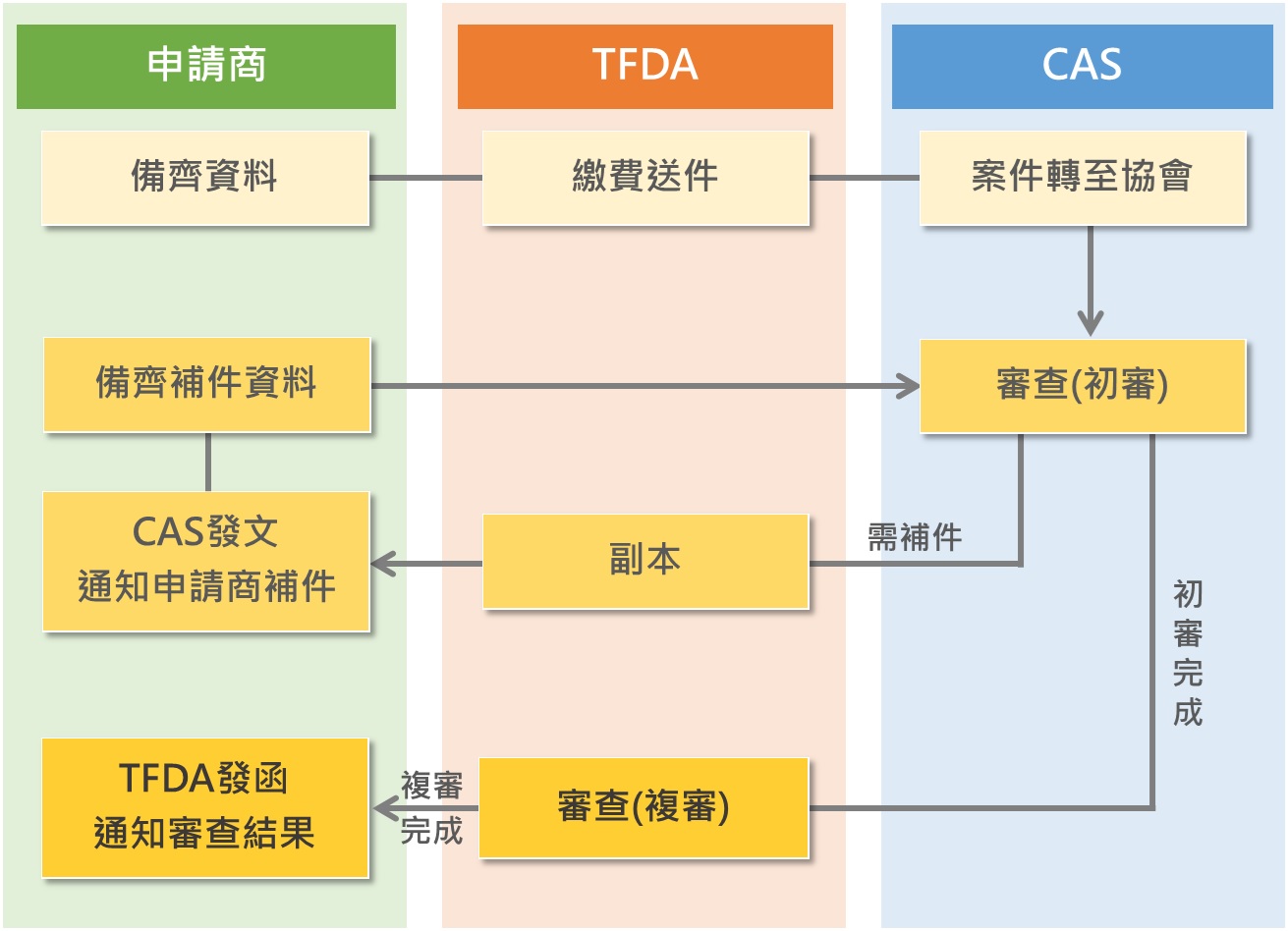
輸入錠狀膠囊狀食品查驗登記所需文件
- 查驗登記申請書
- 原料成分含量表
- 原製造廠為合法製售工廠之官方證明文件
- 申請廠商公司登記或商業登記證明
- 原裝完整樣品
- 食品明細表
- 切結書
- 查驗登記資料表
- 其他有關資料及審查費
輸入錠狀膠囊狀食品查驗登記服務流程
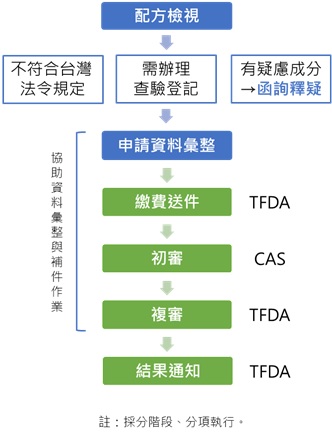
許可文件展延、變更、移轉、遺失補發
麥德凱生科亦提供辦理輸入錠狀膠囊狀食品許可文件之展延、變更、轉移等服務,如果您需要查驗登記申請或許可文件展延變更等協助,歡迎聯絡我們。
非傳統性食品原料申請 文章數: 1
非傳統性食品原料概說
根據衛生福利部於2018年5月10日公告之非傳統性食品原料申請作業指引,「非傳統性食品原料」定義如下:
- 於台灣境內無食用歷史(食用時間未達25年以上),或有食用歷史、惟尚未攝取至一定經驗程度者,如僅有某特定區域或族群之消費者食用經驗。。
- 傳統性食品原料經由非傳統方式培育、繁殖程序或新穎之食品加工製程,而導致食品組成或結構改變者(不包含基因改造食品或輻射照射處理食品)。
為避免食用後造成健康之危害,故須經安全性及風險評估,並透過完整資料收集,以審核原料之食用安全性,提供各食品業者參考。
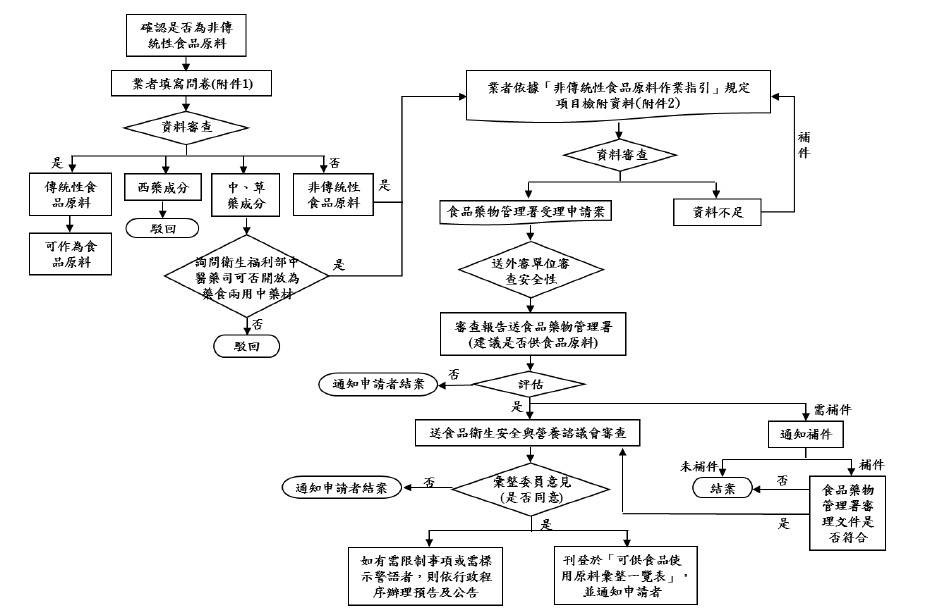
非傳統性食品原料判定
在進行非傳統性食品原料安全性評估前,業者應填寫問卷,並檢具相關佐證資料,送交衛生福利部食品藥物管理署審查,判斷申請案是否屬於指引所稱非傳統性食品原料之範疇。其判定結果大致如下:
- 傳統性食品原料:無需進行安全性評估。
- 西藥成分:駁回。
- 中草藥成分:可詢問衛生福利部中醫藥司是否開放為藥食兩用中藥材,若獲准,則進行非傳統性食品原料之申請。
- 非傳統性食品原料:提具申請書及相關安全性資料以供審查。
非傳統性食品原料申請所需毒理試驗資料

非傳統性食品原料安全性評估作業流程
非傳統性食品原料申請所需文件
- 申請書
- 申請人基本資料
- 原料基本資料
- 飲食攝取資料
- 毒理試驗及其他足以說明安全性之相關資料
- 標示及使用說明書
- 世界各國準用或拒絕之法規資料
- 其他必要性資料
非傳統性食品原料申請服務流程
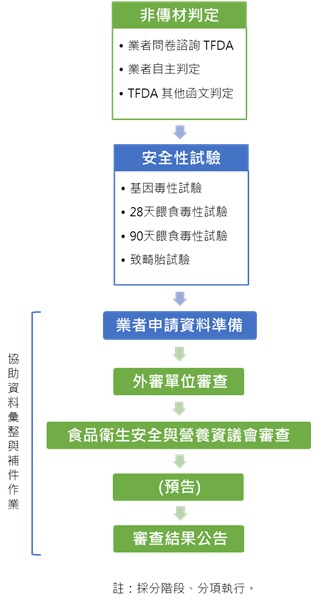
如果您需要非傳統性食品原料安全性評估試驗或申請的協助,歡迎聯絡我們。
衍伸閱讀:非傳統性食品原料安全性試驗
實驗動物與設備 文章數: 0
醫療器材 文章數: 0
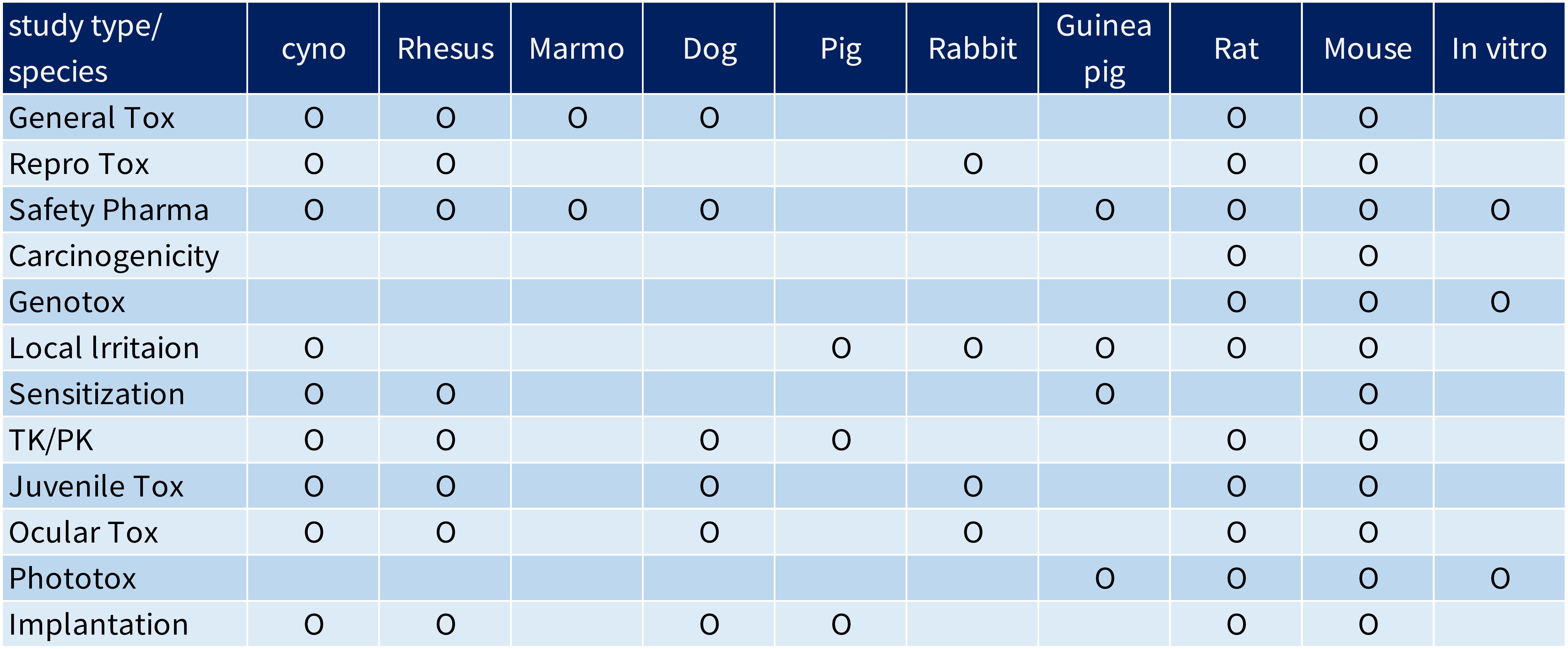
隨著社會高齡化的趨勢,醫療保健市場的需求日益擴大,各國主管機關在依循國際標準規範的準則下分別訂定醫療器材上市管理辦法,其中產品安全性及有效性是驗證的首要目標。在ISO 10993標準規範下,舉凡直接或間接接觸人體的醫材產品,都需要遵循此規範評估其生物相容性,並且依規定必需在GLP認證實驗室完成相關試驗,以確保降低產品上市後風險。
麥德凱生科擁有TAF及GLP雙認證動物實驗中心,集結超過10年臨床前試驗經驗的博士級試驗主持人及獸醫師,對試驗人員資格嚴格把關,秉持專業的態度與實驗技術,提供醫療器材及生醫材料之生物相容性試驗服務,除了提供專業法規諮詢服務協助客戶解決產品製程上遇到的問題,也規劃最有效率的試驗排程幫助客戶在最短的時間內完成產品的查驗登記,報告書已通過歐盟CE、美國FDA及台灣TFDA認可,專業的服務已深受市場肯定。
生物相容性ISO 10993 文章數: 16
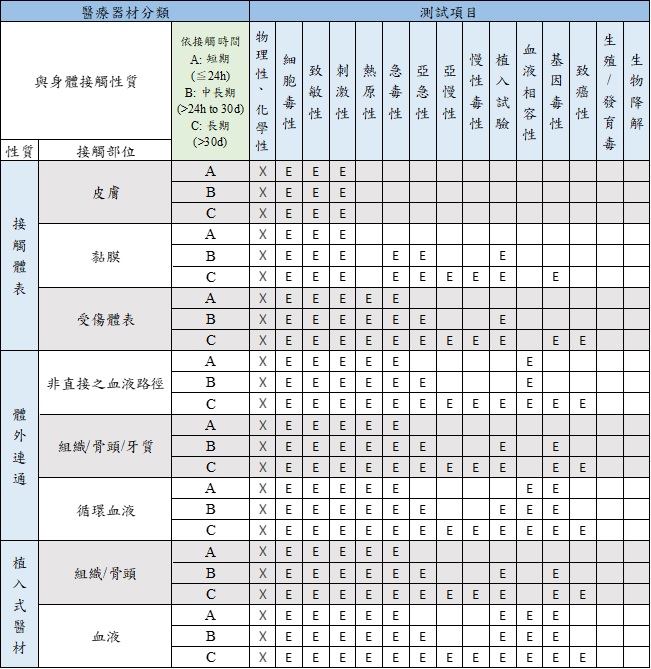
修改自ISO 10993-1:2018版Table A.1-Endpoints to be addressed in a biological risk assessment
註:
1) 首要蒐集產品材料的物理性及化學性資料並進行生物相容性風險評估。
2) 新版標準測試項目增加了熱原性(Material mediated Pyrogenicity)、慢毒性(Chronic toxicity)、致癌性(Carcinogenicity) 、生殖毒性及生物降解性。
3) X表示生物相容性風險評估前置作業,E表示要在風險評估中評估的試驗指標,可藉由進行試驗或是風險評估報告完成該試驗指標的評估。
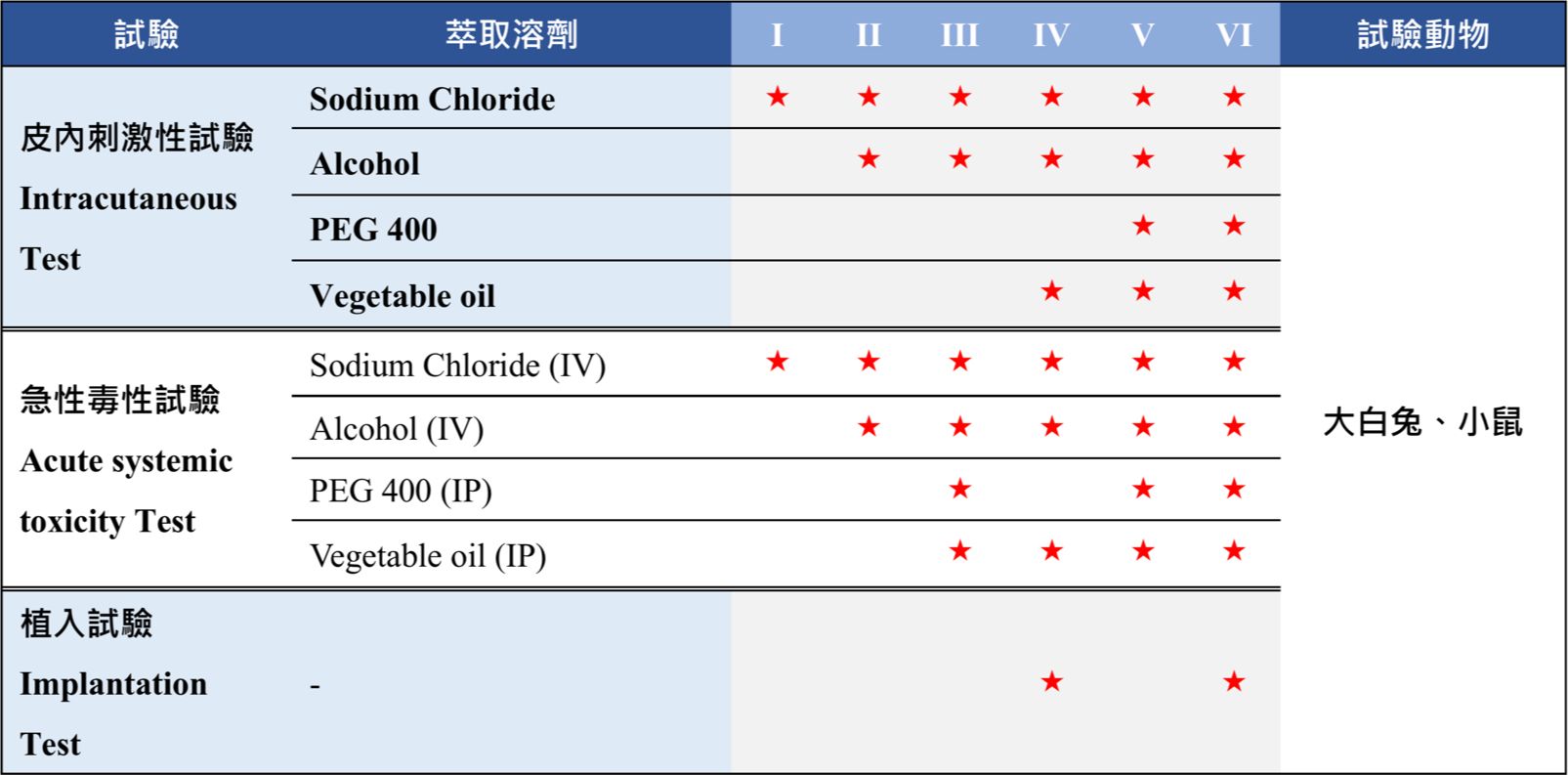
醫療等級原料評估試驗USP 88 文章數: 3
針對醫療等級原料的安全性測試,美國藥典 United States Pharmacopeia, USP 88規範相關的等級及試驗需求,依照塑膠及高分子原料接觸人體風險的等級分類,最高等級為第六等級Class VI植入性醫療原料。一般來說最終的醫療器材產品會依據ISO 10993完成安全性評估,而醫療用的原料因為尚未確定銷售客群則會根據美國藥典的生物測試進行初步篩選。 USP 88包含三種試驗 : 皮內刺激性試驗、急性系統毒性試驗、植入試驗。