醫療等級原料評估試驗USP 88
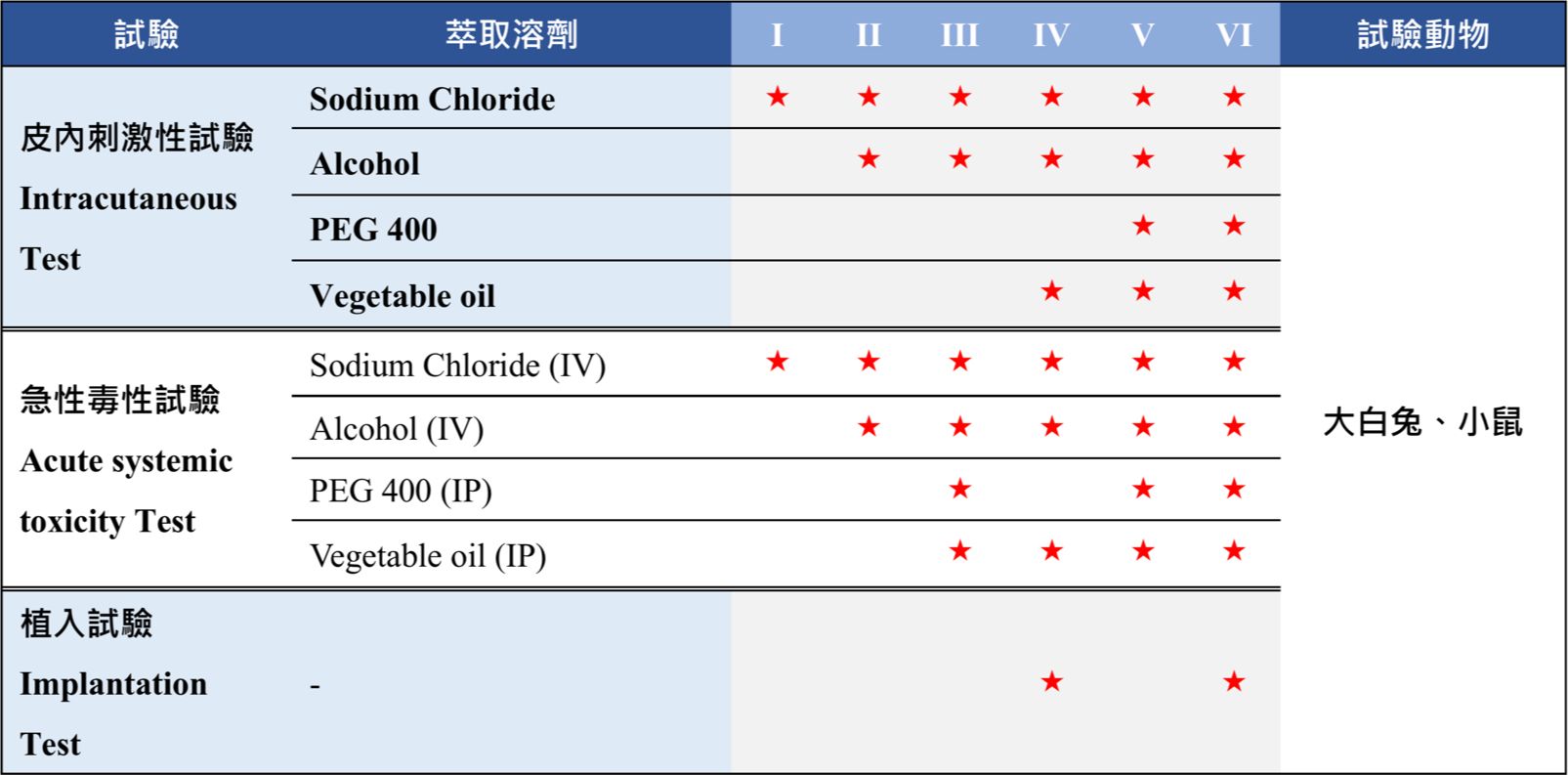
針對醫療等級原料的安全性測試,美國藥典 United States Pharmacopeia, USP 88規範相關的等級及試驗需求,依照塑膠及高分子原料接觸人體風險的等級分類,最高等級為第六等級Class VI植入性醫療原料。一般來說最終的醫療器材產品會依據ISO 10993完成安全性評估,而醫療用的原料因為尚未確定銷售客群則會根據美國藥典的生物測試進行初步篩選。 USP 88包含三種試驗 : 皮內刺激性試驗、急性系統毒性試驗、植入試驗。
大白兔皮內刺激性試驗 Intracutaneous Irritation Study in White Rabbits
- 依循標準
USP 88 Biological Reactivity Tests, In Vivo
- 試驗體系
紐西蘭大白兔
- 萃取溶劑
氯化鈉注射液(sodium chloride injection)、氯化鈉注射液稀釋之5%酒精溶液(alcohol in sodium chloride injection)、聚乙二醇400(polyethylene glycol 400)、棉花籽油(cottonseed oil)
- 試驗目的與方法
評估醫療等級原料或藥物引發皮內刺激之潛在可能性。
測試物萃取後,注射至測試部位,觀察3天內局部炎症反應。
- 符合規範之結果
無紅斑、浮腫等刺激反應。
全身急毒性小鼠注射試驗 Acute Systemic Toxicity Study in Mice
- 依循標準
USP 88 Biological Reactivity Tests, In Vivo
- 試驗體系
小鼠
- 萃取溶劑
氯化鈉注射液(sodium chloride injection)、氯化鈉注射液稀釋之5%酒精溶液(alcohol in sodium chloride injection)、聚乙二醇400(polyethylene glycol 400)、棉花籽油(cottonseed oil)
- 試驗目的與方法
評估分別引發全身急毒性之潛在可能性。
測試物萃取後,以尾靜脈注射或腹腔注射單一劑量,於投予後3天內觀察試驗動物之臨床症狀及臟器病變。
- 符合規範之結果
無試驗造成之生理病變或全身急毒性反應。
大白兔7天肌肉植入試驗 Muscle Implantation Study in White Rabbits for 7 Days
- 依循標準
USP 88 Biological Reactivity Tests, In Vivo
- 試驗體系
紐西蘭大白兔
- 萃取溶劑
不萃取,直接植入
- 試驗目的與方法
評估醫療等級原料引發刺激性與不良反應之潛在可能性。
將測試物直接植入大白兔肌肉,7天後觀察植入點及其周圍組織之損傷及量測包膜厚度。
- 符合規範之結果
無異常臨床症狀,植入物未引起明顯組織異常且測試物與對照物質植入部位之平均包膜厚度不大於1.0。
